GASES
INTRODUCCIÓN
En este trabajo conoceremos 4 leyes de los gases,y como influyen en este los eventos físicos que los alteran que son Temperatura,Presión,Volumen y cantidad que se trate.
OBJETIVOS
- Aprender a resolver los ejercicios a partir de las leyes de los gases
- Identificar que tipo de ley de gases toca usar en los ejercicios
- Conocer las ecuaciones o formulas en cada ley, retener las unidades para gases ideales y las equivalencias para realizar las conversiones necesarias
- Comprender el concepto de cada ley
MARCO TEORICO
¿QUE ES UN GAS?
ESTADOS DE AGREGACIÓN
Los estados de agregación, sólido, líquido y gaseoso, dependen fundamentalmente de las condiciones de presión y temperatura a las que esté sometida la materia
TEMPERATURA
Es una medida de la energía cinética media de los átomos y moléculas que constituyen un sistema. Dado que la energía cinética depende de la velocidad, podemos decir que la temperatura está relacionada con las velocidades medias de las moléculas del gas.
Hay varias escalas para medir la temperatura; las más conocidas y utilizadas son las escalas Celsius (ºC), Kelvin (K) y Fahrenheit (ºF).

PRESIÓN
La presión de un gas está relacionada con el número de choques por unidad de tiempo de las moléculas del gas contra las paredes del recipiente. Cuando la presión aumenta quiere decir que el número de choques por unidad de tiempo es mayor.
VOLUMEN
Los gases ocupan todo el volumen disponible del recipiente en el que se encuentran. Decir que el volumen de un recipiente que contiene un gas ha cambiado es equivalente a decir que ha cambiado el volumen del gas.
CANTIDAD DE GAS
Se relaciona con el número total de moléculas que la componen,para medir la cantidad de un gas usamos como unidad de medida el mol.Un mol es una cantidad igual al llamado número de Avogadro. Demostración:
1 mol de moléculas= 6,022·1023 moléculas
1 mol de átomos= 6,022·1023 átomos
LEYES
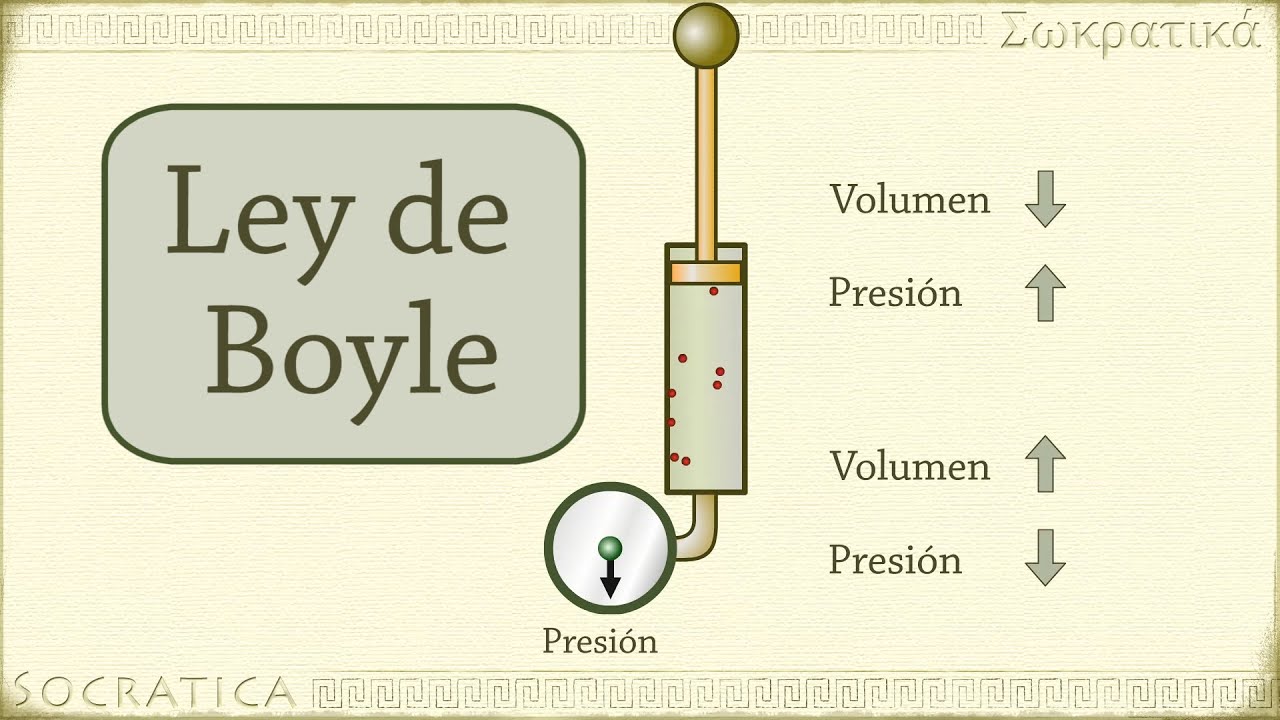
LEY DE BOYLE Y MARIOTTE
Dice que a temperatura constante el volumen de una muestra de gas seco varia en forma inversamente proporcional a la presión a que se someta.Es la relación entre la presión y el volumen de un gas cuando la temperatura es constante.
ECUACION: V1 = P2 Y se multiplican en X:
V2 P1 V1.P1=P2.V2

LEY DE CHARLES
A presión constante el volumen de un gas varia directamente proporcional a su temperatura absoluta.Es la relación entre la temperatura y el volumen de un gas cuando la temperatura es constante.
ECUACION: V1 = V2 Se multiplican en X:
T1 T2 V1.T2= V2.T1

LEY DE GAY-LUSSAC
Establece la relación entre la temperatura y la presión de un gas cuando el volumen es constante.Manteniendo el volumen constante la presión de un gas es directamente proporcional a su temperatura absoluta.
ECUACION: P1 = P2 Se multiplican en X:
T1 T2 P1.T2=P2.T1
LEY GENERAL DE LOS GASES IDEALES O ECUACION GENERAL DE LOS GASES IDEALES
Las leyes parciales analizada precedentemente pueden combinarse y obtener una ley o ecuación que relaciones todas las variables al mismo tiempo.
Según esta ecuación o ley general
P.V = R (CONSTANTE)
T
Esto significa que, si tenemos una cantidad fija de gas y sobre la misma variamos las condiciones de presión (P), volumen (V) o temperatura (T) el resultado de aplicar esta fórmula con diferentes valores, será una constante.
Veamos un ejemplo, para aclarar:
Supongamos que tenemos una cierta cantidad fija de un gas (n1), que está a una presión (P1), ocupando un volumen (V1) a una temperatura (T1)
Estas variables se relacionan entre sí cumpliendo con la siguiente ecuación:
P.V= n.R.T
Donde R es una constante universal conocida ya que se puede determinar en forma experimental.
La misma fómula nos permite calcular el volumen molar de un gas (n)
n= PV
RT
A partir de la ecuación de estado podemos dar solución a otros problemas relativos a masa molecular o densidad para los gases a unas condiciones dadas.Para ello se calcula el numero de moles (n) en una muestra de gas dividiendo la masa de la muestra (m) por la masa de una mol (M) del gas asi.
n= m M
Remplazando este valor n en la ecuacion de estado de los gases y ordenando la igualdad queda:
PM= m R.T
V
Como la densidad (d) es igual a masa obtenemos:
volumen
PM= d.R.T
PROCEDIMIENTO
LABORATORIO
Sala de Boyle


Sala de Charles






EJERCICIOS LEY DE BOYLE





EJERCICIOS LEY DE CHARLES




CONCLUSIONES
- Es muy importante saberse las leyes de los gases y saber las características para poder identificarlos
- Todas las leyes son importantes en un laboratorio químico para saber cual reacciona si se le aplicara calor,se le aumente la presión y eso
- Es muy importante saberse las equivalencias de litros,de atmósfera
WEBGRAFIA
MARCO TEÓRICO:
- https://www.definicionabc.com/general/gas.php
- http://www.profesorenlinea.cl/fisica/GasesLeyes.htm
- http://www.educaplus.org/gases/ley_charles.html
- https://www.monografias.com/trabajos91/leyes-gases-quimica/leyes-gases-quimica.shtml
PROCEDIMIENTO:



COMO RESOLVIO LOS EJERCICIOS? 4.0
ResponderEliminar